ANTECEDENTES
El síndrome de ovario poliquístico es la enfermedad ginecológica y endocrina más frecuente en mujeres en edad reproductiva,1-4 además de una de las causas más comunes de hiperandrogenismo (hirsutismo, acné) y anovulación (alteraciones menstruales e infertilidad).3 Este padecimiento incrementa el riesgo de síndrome metabólico, diabetes mellitus tipo 2 y enfermedad cardiovascular.5 Aunque se describió hace más de 70 años, no existe un consenso de criterios diagnósticos; por lo tanto, la prevalencia varía de 4 a 16%, según diferentes autores.6-10
Se han propuesto tres consensos para identificar a las mujeres con síndrome de ovario poliquístico: 1) National Institute of Health (NIH)11 en el año de 199012; 2) European Society for Human Reproduction and Embryology (ESHRE) y American Society for Reproductive Medicine (ASRM) en Rotterdam en el año 20038,13 y 3) Androgen Excess and PCOS Society (AE-PCOS) en el 2006.14
Existen ventajas y desventajas con cada criterio. Los criterios del NIH (1990) representan el núcleo de todas las pacientes con síndrome de ovario poliquístico. Los de Rotterdam y de la Androgen Excess Society Guideline (AES) amplían la definición y aumentan los posibles fenotipos.14,15 Los criterios del NIH (1990) y de la AES (2006) definen una población con mayor riesgo de resistencia a la insulina que la población general.14-16 Los criterios de Rotterdam (2003) definen un grupo más heterogéneo, donde la incidencia de resistencia a la insulina es más baja que con los otros criterios.14-16
En el año 2010, Dewailly y sus colaboradores17 propusieron una clasificación más simple para establecer el diagnóstico: la oligoanovulación y el hiperandrogenismo. Cuando alguno de estos no se manifiestan puede determinarse la cuenta folicular antral o las concentraciones séricas de hormona antimulleriana para reemplazarlos. Este criterio los llevó a enfocarse en otra meta: determinar el punto de corte para la cuenta folicular antral y la concentración sérica de hormona antimulleriana para definir el ovario poliquístico. En el año 2011 propusieron un punto de corte para la cuenta folicular antral de 19 folículos y una concentración de hormona antimulleriana mayor de 35 pmol (5 ng/mL), con lo que encontraron mayor sensibilidad y especificidad con esta última.18
Estos resultados repercuten en la prevalencia y cambian la estimación según el criterio diagnóstico utilizado. No obstante, existen dos reportes clásicos de prevalencia que continuamente son citados en la población europea caucásica: el de Diamanti-Kandarakis y sus colaboradores,19 que reporta una prevalencia de 6.7% en la población griega (13 mujeres de 192), y el de Asunción y su grupo7 que demostraron 6.5% en donantes de sangre en España (10 mujeres de 154).
El objetivo de este estudio es determinar la prevalencia actual del síndrome de ovario poliquístico en un grupo de mujeres no seleccionadas españolas e identificar los fenotipos más comunes de la enfermedad.
MATERIAL Y MÉTODOS
Estudio observacional, transversal y de prevalencia. Se consideró como referencia la prevalencia de 6% de síndrome de ovario poliquístico en la población general, con intervalo de confianza (IC) de 95% para estimar un tamaño de muestra de 240 pacientes.20
Nuestra región está dividida en nueve áreas (I-IX) por el sistema público de salud.21 De acuerdo con este modelo, se seleccionó la número VI para efectuar el estudio. En esta área de salud se atienden 241,786 habitantes de 1,472,049 de la región total, según el último reporte censal.22
Se invitó a las mujeres a participar en el estudio a través de médicos generales de primer contacto en los centros de salud públicos, dependientes del Área de Salud VI. El estudio fue aprobado por el comité de ética del Hospital Universitario Morales Meseguer (Código: CP IMAR-2014 - C.I. AVAL: 10/14). Todas las participantes firmaron el consentimiento informado y recibieron evaluación médica completa, ecografía transvaginal ginecológica y se les realizó análisis de sangre.
Se incluyeron mujeres en edad reproductiva (18-40 años), con vida sexual activa, que aceptaran participar en el estudio y no recibieran medicación hormonal tres meses antes de ingresar al estudio.
Todas las pacientes respondieron un cuestionario para indicar sus antecedentes familiares y personales, como: edad, menarquia, antecedente menstrual, afecciones de la piel, antecedentes de enfermedades metabólicas o cualquier enfermedad ginecológica. A cada participante se le realizó un examen físico completo, con medición del peso, la talla y la tensión arterial, y uno pélvico para descartar alteraciones uterinas y ováricas.
La severidad del hirsutismo se clasificó con un puntaje mayor de 6, según la escala modificada Ferriman-Gallwey (mF-G),23,24 y la del acné se gradúa de acuerdo con la Consensus Conference on Acne Classification.25
Se realizó ecografía transvaginal a cada paciente durante su examen físico, entre los días 2 y 3 del ciclo menstrual, para determinar el número de folículos antrales y el volumen ovárico.
El diagnóstico de síndrome metabólico se estableció según las guías del National Cholesterol Education Program (NCEP) ATP III del 2005.26 Otros diagnósticos incluyeron: estimación de sobrepeso (IMC ≥25 kg/m2) y obesidad (IMC ≥30 kg/m2); determinación de lípidos, hiperlipidemia, triglicéridos ≥1.7 mmol/L o colesterol HDL <1.29 mmol/L; resistencia a la insulina mediante el homoeostatic model assessment (HOMA-IR) >2.69; e hipertensión arterial, ≥140/90 mmHg en dos ocasiones separadas.
Se efectuaron análisis sanguíneos a cada participante en el día 2 o 3 del ciclo menstrual para evaluar: glucosa, insulina en ayuno y perfil de lípidos; FSH, LH, estradiol, prolactina, testosterona total, globulina fijadora de hormonas sexuales, índice de andrógenos libres, 17-OH progesterona, TSH y T3.
El diagnóstico de síndrome de ovario poliquístico se estableció de acuerdo con los criterios descritos en el Cuadro 1.
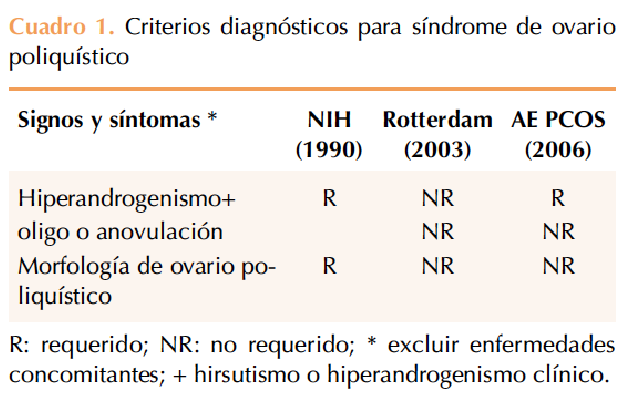
Cada criterio se define como sigue:
- Hiperandrogenismo clínico: valor en la escala modificada de Ferriman-Gallwey (mF-G) igual o mayor de 6, acné, alopecia, o ambos.
- Hiperandrogenismo bioquímico (hiperandrogenemia): testosterona total (tT) y concentración de andrógenos libres mayores de 54.7 y 4.94 ng/dL, respectivamente.
- Oligo o anovulación: ciclos menstruales iguales o mayores de 35 días.
- Morfología de ovario poliquístico (PCOm): para su definición se utilizó la propuesta más reciente, de más de 19 folículos antrales en cualquier ovario o volumen ovárico igual o mayor de 10 mL.18
- Exclusión de enfermedades concomitantes: para descartar la oligoanovulación se determinaron las concentraciones de hormona estimulante de tiroides y prolactina. La determinación de 17-OH-progesterona se evaluó para excluir hiperplasia suprarrenal congénita no clásica.
Se utilizó el programa IBM SPSS Statistics versión 21 para OSX (Mac), estadística descriptiva y Anova para evaluar las variables continuas y determinar la significación estadística, además de χ2 para las variables categóricas.
RESULTADOS
Entre julio y octubre de 2014 se registraron 245 voluntarias que aceptaron participar en el estudio; sin embargo, se excluyeron 3 mujeres embarazadas, pues su estado fisiológico alteraría los resultados.
La media de edad fue de 30.63±2.7 años y el IMC de 25.05±4.5 kg/m2. Se establecieron grupos según los criterios diagnósticos utilizados (Cuadro 2). Se encontró significación estadística en la edad, IMC, escala modificada de Ferriman-Gallwey, cuenta y volumen folicular antral de ambos ovarios; glucosa e insulina en ayuno, resistencia a la insulina (homoeostatic model assessment), triglicéridos, testosterona total, globulina fijadora de hormonas sexuales, concentración de andrógenos libres y LH. No se observaron diferencias en la circunferencia abdominal, colesterol total, perfil tiroideo, FSH, estradiol, ni prolactina.
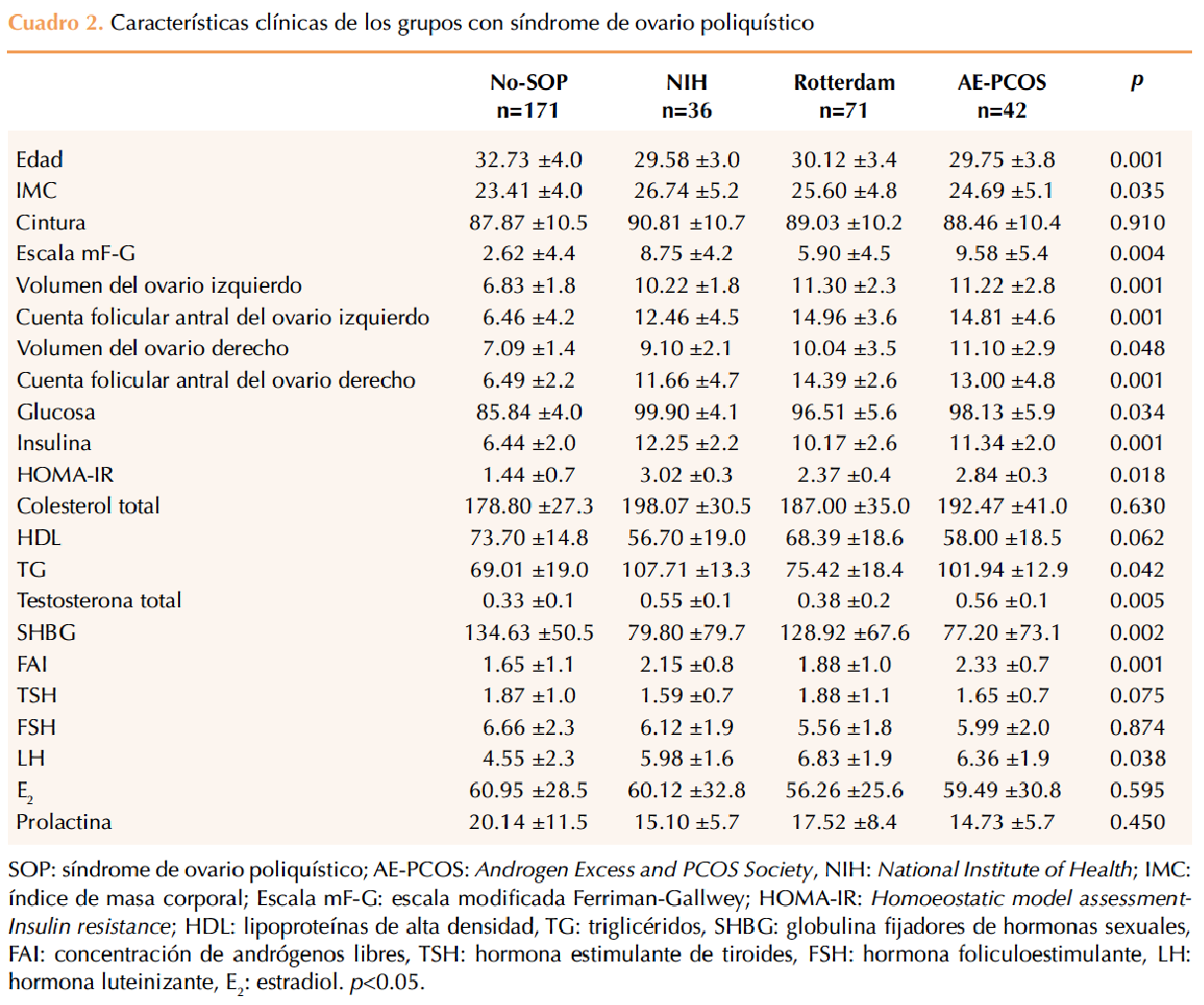
La prevalencia de síndrome de ovario poliquístico, según los criterios de NIH fue de 14.8% (n=36), con Rotterdam de 29.3% (n=71) y con AE-PCOS Society de 17.3% (n=42).
De acuerdo con los criterios de Rotterdam las pacientes con síndrome de ovario poliquístico se clasificaron en cuatro fenotipos:27: a) síndrome de ovario poliquístico con sus tres componentes clásicos: anovulación, hiperandrogenismo y morfología de ovario poliquístico; b) síndrome de ovario poliquístico sin morfología de ovario poliquístico; c) síndrome de ovario poliquístico ovulatorio (hiperandrogenismo y morfología de ovario poliquístico); y d) síndrome de ovario poliquístico sin hiperandrogenismo. Se encontró una prevalencia de 40.8% (29/71), 25.3% (18/71), 8.4% (6/71) y 25.3% (18/71) para cada fenotipo, respectivamente (Cuadro 3).

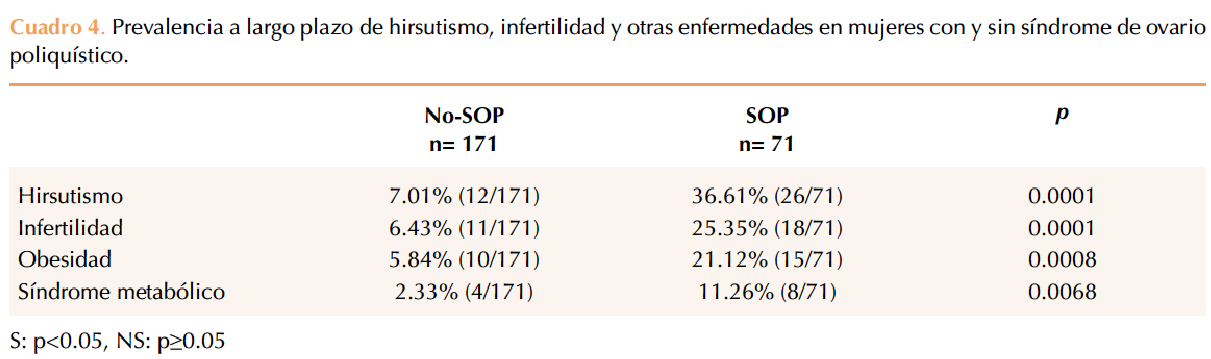
La prevalencia de hirsutismo fue de 7.0% (12/171) vs 36.6% (26/71) en mujeres con y sin síndrome de ovario poliquístico, respectivamente, con diferencia estadística significativa. La infertilidad reportó una prevalencia de 6.4% (11/171) para mujeres sin síndrome y de 25.3% (18/71) con síndrome de ovario poliquístico, con diferencia estadística (Cuadro 4).
La obesidad se reportó en 10/171 (5.8%) mujeres sin síndrome versus 15/71 (21.1%) con síndrome de ovario poliquístico, con diferencia estadística entre los grupos. El síndrome metabólico tuvo una prevalencia de 2.3% (4/171) vs 11.2% (8/71) para mujeres con y sin síndrome de ovario poliquístico, respectivamente (Cuadro 4).
DISCUSIÓN
La prevalencia de síndrome de ovario poliquístico depende de los criterios utilizados para definirlo. Hasta la fecha se ha determinado, principalmente, con los criterios de la NIH de 1990. No obstante, la mayor parte de los estudios utiliza los de Rotterdam para determinar la prevalencia.
Knochenhauer y sus colaboradores6 reportaron una prevalencia de síndrome de ovario poliquístico de 4% en 277 mujeres de Estados Unidos. El estudio de Azziz y su grupo,8 realizado en 400 mujeres no seleccionadas, reportó una prevalencia de 6.6%. Otros estudios demuestran diferencias raciales en mujeres con síndrome de ovario poliquístico: las mujeres caucásicas tienen menor prevalencia (4.8%) que las de raza negra (8.0%) y las mexicano-americanas (12.8%). Estos autores no reportaron diferencias estadísticas entre los grupos raciales, quizá debido al tamaño inadecuado de la muestra. Es importante comentar que utilizaron los criterios de NIH para sus estudios.
Diamanti-Kandarakis y sus colaboradores19 estudiaron 192 mujeres griegas, en la isla de Lesbos, y reportaron una prevalencia de síndrome de ovario poliquístico de 6.8%. En España, Asunción y su grupo evaluaron 154 mujeres donantes de sangre y encontraron una prevalencia similar (6.5%). Ambos estudios son importantes porque se realizaron en la población europea caucásica, este último efectuado en España, como nuestro estudio. En nuestra investigación encontramos un aumento importante de la prevalencia (14.8%) con los criterios de NIH, incluso más alto (29.3%) cuando se aplicaron los de Rotterdam.
En el año 2006, Broekmans y su grupo15 compararon la prevalencia de síndrome de ovario poliquístico diagnosticado con los criterios NIH versus Rotterdam en mujeres con anovulación gonadotrópica normal (anovulación II de la Organización Mundial de la Salud), además de evaluar la frecuencia de obesidad y factores relacionados. En total, clasificaron 827 mujeres con oligomenorrea tipo II OMS, 456 (55%) con el criterio NIH (oliganovulación e hiperandrogenismo) y 754 (91%) con el de Rotterdam, con diferencia absoluta de 36% y significación estadística. De las pacientes clasificadas con síndrome de ovario poliquístico de NIH, 404 (89%) tuvieron morfología de ovario poliquístico, por lo que también cumplieron los tres criterios de Rotterdam. La prevalencia de obesidad se relacionó con hiperandrogenismo, que es más frecuente en el grupo de síndrome de ovario poliquístico diagnosticado con NIH (61%) versus Rotterdam (45%). La proporción de mujeres con glucosa elevada y resistencia a la insulina fue superior con el criterio NIH versus Rotterdam (4 y 2%, respectivamente), con diferencia estadística (27 vs 18% de síndrome de ovario poliquístico de NIH y Rotterdam, respectivamente).
Esta información demuestra que los criterios de Rotterdam expanden la definición del síndrome de ovario poliquístico y detectan una población con diferentes factores de riesgo a largo plazo, por lo que debe definirse de mejor manera. Por esta razón decidimos clasificar a las pacientes con síndrome de ovario poliquístico en los cuatro fenotipos básicos y establecer su riesgo metabólico.
El Cuadro 4 muestra las diferencias con significación estadística entre la prevalencia de hirsutismo, infertilidad y obesidad. El diagnóstico de síndrome metabólico es estadísticamente significativo en el grupo de síndrome de ovario poliquístico, dato similar al estudio de Hudecova y colaboradores,28 donde además encontraron que este riesgo es independiente del fenotipo. Panidis y su grupo29 reportaron elevada prevalencia de síndrome metabólico en mujeres con síndrome de ovario poliquístico; sin embargo, después de efectuar el análisis de regresión logística concluyeron que no pronostica el síndrome metabólico por si mismo y que la probabilidad más bien es dependiente del IMC.
March y sus colaboradores30 estudiaron 728 mujeres seleccionadas por registros de nacimiento en un hospital de maternidad para tener una muestra más representativa. Se diagnosticaron 63 mujeres con síndrome de ovario poliquístico con los criterios de NIH (1990), con prevalencia de 8.7%; 87 mujeres cumplieron los criterios de Rotterdam (2003), con una prevalencia de 11.9%; y 74 mujeres se diagnosticaron según los criterios de la AE-PCOS Society, con prevalencia de 10.2%. Este estudio tuvo como característica importante la selección de las pacientes; sin embargo, se restringe a mujeres de entre 27 y 34 años de edad y limita el valor real de la prevalencia. Otro punto débil encontrado fue que no realizaron los estudios ecográficos ni los análisis sanguíneos en pacientes sin signos clínicos de síndrome de ovario poliquístico. Al ajustar algunas de esas variables “confusoras” se observaron porcentajes mucho más altos en la prevalencia, incluso de 17.8% con los criterios de Rotterdam y de 12% con los de AE-PCOS Society, pero no dejan de ser valores estimados.
En el año 2012, Yildiz y su grupo16 publicaron un estudio de prevalencia, fenotipo y riesgo cardiometabólico en pacientes con síndrome de ovario poliquístico con los diferentes criterios diagnósticos. Los autores señalaron una prevalencia del síndrome, según los criterios de NIH (1990), Rotterdam (2003) y AE-PCOS Society (2006) de 6.1, 19.9 y 15.3%, respectivamente, en la población caucásica. Además, encontraron que la morfología del ovario poliquístico es el componente más común de los fenotipos, con prevalencia de 36.5%, mientras que el hiperandrogenismo y la disfunción ovárica se observan solo en 24.8 y 15.3%, respectivamente. La prevalencia de síndrome metabólico se incrementa 2 veces más en mujeres con síndrome de ovario poliquístico sin importar el criterio diagnóstico utilizado. En nuestro estudio no encontramos este riesgo.
El estudio más grande de prevalencia lo realizaron Li y sus colaboradores en China.31 En ese estudio utilizaron los criterios de Rotterdam para identificar a las mujeres con síndrome de ovario poliquístico. Se registraron 15,924 pacientes de 152 ciudades y 112 villas, con prevalencia de 5.6% (894 mujeres) y se clasificaron en cuatro fenotipos: 1) hiperandrogenismo y anovulación crónica (19%); 2) hiperandrogenismo y ovarios poliquísticos (37%); 3) anovulación crónica y ovarios poliquísticos (15%); y 4) hiperandrogenismo, anovulación crónica y ovarios poliquísticos (29%). Los autores señalan que las mujeres obesas con síndrome de ovario poliquístico tienen mayor riesgo de síndrome metabólico, resistencia a la insulina, hipertensión e hiperlipidemia.
Uno de los estudios más recientes de prevalencia es el de Lauritsen y su grupo,32 donde señalan la importancia de la selección y clasificación de las pacientes. Encontraron una prevalencia de síndrome de ovario poliquístico de 16.6% con los criterios de Rotterdam en las trabajadoras del sector salud. Lo más interesante es que utilizaron los criterios propuestos recientemente por la AFC y AMH para el diagnóstico de síndrome de ovario poliquístico,18 con lo que disminuyó la prevalencia a 6.3 y 8.5% con los criterios de NIH y Rotterdam, respectivamente. Estos resultados están por debajo de nuestros hallazgos y sugieren diferencias más allá de solo las raciales.
Está establecido que los estudios de prevalencia con el criterio NIH 1990 (4-8%) excluyen al menos dos fenotipos importantes; por lo tanto, al expandir la definición con los criterios de Rotterdam (10-16%) pueden identificarse grupos más grandes de pacientes que pueden beneficiarse del tratamiento oportuno (mujeres con riesgo de síndrome metabólico, diabetes tipo 2, enfermedad cardiovascular y cáncer endometrial).
Los fenotipos de síndrome de ovario poliquístico también dependen de los criterios diagnósticos utilizados. Debido a esta confusión, en diciembre de 2012 el NIH organizó un grupo de trabajo basado en la evidencia para discutir e identificar futuras prioridades acerca del síndrome de ovario poliquístico.33
El grupo de trabajo debía aclarar las ventajas y debilidades de cada criterio diagnóstico; las causas, predictores y consecuencias a largo plazo del síndrome de ovario poliquístico, además de las estrategias óptimas de prevención y tratamiento. Mostraron una tabla basada y modificada en el modelo de Azziz y su grupo34 y encontraron 10 posibles fenotipos, según los tres criterios diagnósticos establecidos. Esta tabla incluye todas las posibles combinaciones y su integración en cada uno de los criterios.
De acuerdo con los datos de Norman y su grupo27 y Broekmans y sus colaboradores,15 decidimos combinar los fenotipos que se muestran en el Cuadro 4. Nuestra meta no es solo simplificar los fenotipos, sino definir cuál es el más común en nuestra población, con la finalidad de mejorar el diagnóstico, tratamiento y pronóstico de la morbilidad relacionada.
Este factor es importante debido a que el fenotipo más común es el descrito como clásico (oligo o anovulación, hiperandrogenismo y ovarios poliquísticos) en la población caucásica. En nuestra población, el fenotipo más frecuente también fue el clásico; sin embargo, los fenotipos B (oligoanovulación e hiperandrogenismo) y D (oligoanovulación y ovarios poliquísticos), mostraron una prevalencia significativa (25.35 y 21.12%, respectivamente).
Al identificar otra forma de manifestación de la enfermedad podrá establecerse un mejor diagnóstico y tratamiento. Además, el problema más relevante será definir los riesgos de morbilidad (síndrome metabólico, enfermedad cardiovascular y cáncer) en cada fenotipo.
CONCLUSIONES
La prevalencia de síndrome de ovario poliquístico, en su forma clásica, se elevó en la población de estudio. Los puntos fuertes de este estudio fueron: asignación al azar en la selección de pacientes y estimación del tamaño necesario de la muestra para determinar la prevalencia. El fenotipo más común de síndrome de ovario poliquístico incluye la descripción clásica: oligoanovulación, hiperandrogenismo y ovarios poliquísticos por ecografía. Consideramos que el siguiente paso será establecer los factores de riesgo para morbilidad a largo plazo en todos los fenotipos descritos. De este modo se identificará fácilmente a las mujeres con riesgo de enfermedad crónica, con la finalidad de cambiar o modificar el curso de la enfermedad.
Agradecimientos
De manera especial a Silvia Gaona por su altruista y amable apoyo en este trabajo.
REFERENCIAS
- Azziz R, Marin C, Hoq L, Badamgarav E, Song P. Health care-related economic burden of the polycystic ovary syndrome during the reproductive life span. J Clinl Endocrinol Metab 2005;90:4650-8.
- Carmina E, Lobo RA. Polycystic ovary syndrome (PCOS): arguably the most common endocrinopathy is associated with significant morbidity in women. J Clinl Endocrinol Metab 1999;84:1897-9.
- Carmina E, Rosato F, Janni A, Rizzo M, Longo RA. Extensive clinical experience: relative prevalence of different androgen excess disorders in 950 women referred because of clinical hyperandrogenism. J Clinl Endocrinol Metab 2006;91:2-6.
- Essah PA, Nestler JE. The metabolic syndrome in polycystic ovary syndrome. J Endocrinol Invest 2006;29:270-80.
- Amsterdam EA-SrPCWG. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS). Hum Reprod 2012;27:14-24.
- Knochenhauer ES, Key TJ, Kahsar-Miller M, Waggoner W, Boots LR, Azziz R. Prevalence of the polycystic ovary syndrome in unselected black and white women of the southeastern United States: a prospective study. J Clinl Endocrinol Metab 1998;83:3078-82.
- Asuncion M, Calvo RM, San Millan JL, Sancho J, Avila S, Escobar-Morreale HF. A prospective study of the prevalence of the polycystic ovary syndrome in unselected Caucasian women from Spain. J Clinl Endocrinol Metab 2000;85:2434-8.
- Azziz R, Woods KS, Reyna R, Key TJ, Knochenhauer ES, Yildiz BO. The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clinl Endocrinol Metab 2004;89:2745-9.
- Lauritsen MP, Bentzen JG, Pinborg A, Loft A, Forman JL, Thuesen LL, et al. The prevalence of polycystic ovary syndrome in a normal population according to the Rotterdam criteria versus revised criteria including anti-Mullerian hormone. Hum Reprod 2014.
- Michelmore KF, Balen AH, Dunger DB, Vessey MP. Polycystic ovaries and associated clinical and biochemical features in young women. Clin Endocrinol 1999;51:779-86.
- Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Bohm M, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013;34:2159-219.
- Zawadski JK DA. Diagnostic criteria for polycystic ovary syndrome: towards a rational approach. In: Merriam GR, editor. Polycystic ovary síndrome. 1st ed. Boston: Blackwell Scientific Publications, 1992;377-84.
- Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod 2004;19:41-7.
- Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society Guideline. J Clin Endocrinol Metab 2006;91:4237-45.
- Broekmans FJ, Knauff EA, Valkenburg O, Laven JS, Eijkemans MJ, Fauser BC. PCOS according to the Rotterdam consensus criteria: Change in prevalence among WHO-II anovulation and association with metabolic factors. BJOG 2006;113:1210-7.
- Yildiz BO, Bozdag G, Yapici Z, Esinler I, Yarali H. Prevalence, phenotype and cardiometabolic risk of polycystic ovary syndrome under different diagnostic criteria. Hum Reprod 2012;27:3067-73.
- Dewailly D, Pigny P, Soudan B, Catteau-Jonard S, Decanter C, Poncelet E, et al. Reconciling the definitions of polycystic ovary syndrome: the ovarian follicle number and serum anti-Mullerian hormone concentrations aggregate with the markers of hyperandrogenism. J Clin Endocrinol Metab 2010;95:4399-405.
- Dewailly D, Gronier H, Poncelet E, Robin G, Leroy M, Pigny P, et al. Diagnosis of polycystic ovary syndrome (PCOS): revisiting the threshold values of follicle count on ultrasound and of the serum AMH level for the definition of polycystic ovaries. Hum Reprod 2011;26:3123-9.
- Diamanti-Kandarakis E, Kouli CR, Bergiele AT, Filandra FA, Tsianateli TC, Spina GG, et al. A survey of the polycystic ovary syndrome in the Greek island of Lesbos: hormonal and metabolic profile. J Clin Endocrinol Metab 1999;84:4006-11.
- Arya R, Antonisamy B, Kumar S. Sample size estimation in prevalence studies. Indian J Pediatr 2012;79:1482-8.
- Salud M. Gerencias de Áreas de Salud 2014. Gerencias de Áreas de Salud. [en línea]. Dirección URL: <http://www.murciasalud.es/seccion.php?idsec=46>.
- Murcia CRdEd. Población y densidad de población 2013, Murcia 2014. [en línea]. Dirección URL: <http://www.carm.es/econet/sicrem/PU_datosBasicos/sec164.html>.
- Ferriman D, Gallwey JD. Clinical assessment of body hair growth in women. J Clin Endocrinol Metab 1961;21:1440-7.
- Hatch R, Rosenfield RL, Kim MH, Tredway D. Hirsutism: implications, etiology, and management. Am J Obstet Gynecol 1981;140:815-30.
- Reingold SB, Rosenfield RL. The relationship of mild hirsutism or acne in women to androgens. Arch Dermatol 1987;123:209-12.
- Alberti KG, Zimmet P, Shaw J. Metabolic syndrome--a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet Med 2006;23:469-80.
- Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic ovary syndrome. Lancet 2007;370:685-97.
- Hudecova M, Holte J, Olovsson M, Larsson A, Berne C, Sundstrom-Poromaa I. Prevalence of the metabolic syndrome in women with a previous diagnosis of polycystic ovary syndrome: long-term follow-up. Fertil Steril 2011;96:1271-4.
- Panidis D, Macut D, Tziomalos K, Papadakis E, Mikhailidis K, Kandaraki EA, et al. Prevalence of metabolic syndrome in women with polycystic ovary syndrome. Clin Endocrinol 2013;78:586-92.
- March WA, Moore VM, Willson KJ, Phillips DI, Norman RJ, Davies MJ. The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria. Hum Reprod 2010;25:544-51.
- Li R, Zhang Q, Yang D, Li S, Lu S, Wu X, et al. Prevalence of polycystic ovary syndrome in women in China: a large community-based study. Hum Reprod 2013;28:2562-9.
- Lauritsen MP, Bentzen JG, Pinborg A, Loft A, Forman JL, Thuesen LL, et al. The prevalence of polycystic ovary syndrome in a normal population according to the Rotterdam criteria versus revised criteria including anti-Mullerian hormone. Hum Reprod 2014;29:791-801.
- National Institute of Health. Evidence-based Methodology Workshop on Polycystic Ovary Syndrome December 3–5, 2012. [en línea]. Dirección URL: <https://prevention.nih.gov/docs/programs/pcos/FinalReport.pdf>.
- Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertil Steril 2009;91:456-88.






