ANTECEDENTES
La expresión “síndrome genitourinario de la menopausia” corresponde a la nueva terminología para describir los síntomas originados por la atrofia vulvo-vaginal.1,2 El síndrome se manifiesta en alrededor de 15% de las mujeres premenopáusicas3 y en 40 a 54% de las posmenopáusicas.2,4
Las manifestaciones clínicas del síndrome genitourinario de la menopausia derivan del estado hipoestrogénico asociado con la menopausia y sus efectos en el aparato genitourinario.2,5 Se dividen, principalmente, en signos y síntomas genitales y urológicos.2 Los síntomas vaginales más frecuentes incluyen: sequedad vaginal (75% de las mujeres postmenopáusicas), sangrado postcoito (8%), dispareunia (38%), prurito o picazón, secreción y dolor vaginal (15%).2,6,7,8
El hipoestrogenismo lleva a la disminución del contenido de colágeno, elastina y ácido hialurónico; en consecuencia, el epitelio vaginal se adelgaza (se desencadena la alteración en la proliferación del músculo liso y la pérdida de la vascularización) y ello predispone a la vagina a la irritación y al traumatismo sexual.2,9
El diagnóstico más frecuente es en mujeres con dispareunia secundaria a la sequedad vaginal; esto obliga a conformar una historia clínica más minuciosa y orientada.2 La citología del epitelio vaginal muestra aumento en las células parabasales y disminución en las células superficiales; el pH vaginal se incrementa más allá de 4.5.1,2,8
A partir de la posmenopausia decrece la cantidad de receptores de estrógenos de la vagina, pero nunca desaparecen por completo. La administración exógena de estrógenos los reactiva.2,3
Los estrógenos en preparaciones vaginales son el patrón de referencia para tratar los síntomas del síndrome genitourinario de la menopausia; está demostrado que revierten los cambios atróficos en los tejidos pélvicos,2 rápidamente restauran el epitelio vaginal y mejoran el flujo sanguíneo, lo mismo que las secreciones vaginales. Esa presentación de los estrógenos también disminuye el pH vaginal y restaura la flora vaginal, además de potenciar el grosor del epitelio en la vagina, la vejiga y la uretra; en consecuencia, alivian los síntomas vulvovaginales.2,3,10 La absorción sistémica es mínima, con un pico inicial y luego casi sin absorción adicional.2
La crema de estrógenos conjugados de origen equino contiene una mezcla de sales sódicas de los ésteres sulfatados hidrosolubles de estrona, equilina y 17-alfa dihidroequilina en cantidades menores de 17-alfa-estradiol, equilenina, 17-alfa-dihidroequilina, 17-beta-dihidroequilina, 17-beta-estradiol y delta-8,9-dihidroestrona,11 todos ellos biológicamente activos, responsables de los efectos y ventajas clínicas.
El estriol es el estrógeno más débil que existe: tiene una décima parte de la potencia del estradiol; la absorción sistémica es mínima y no se metaboliza a estradiol o estrona.12 Al tener una afinidad diez veces menor por el receptor nuclear, en comparación con el estradiol, se constituye en un estrógeno débil de acción corta.2,13
A partir de una numerosa serie de investigaciones y publicaciones en relación con el tratamiento de la atrofia vaginal,1-3,9 nuestro grupo planteó la necesidad de investigar detalles del tratamiento local con estrógenos para contrarrestar los síntomas del síndrome genitourinario de la menopausia. El objetivo de este ensayo fue: comparar la efectividad y seguridad del estriol vs estrógenos conjugados de origen equino en el tratamiento del síndrome genitourinario de la menopausia.
MATERIALES Y MÉTODOS
Ensayo clínico controlado, con asignación al azar y doble ciego, efectuado en tres clínicas de la ciudad de Armenia, Colombia (Clínica la Sagrada Familia, Clínica Saludcoop-Esimed-Medimas y Clínica El Café), entre el 1 de julio de 2015 y el 30 de septiembre de 2017. Tamaño de la muestra: se calculó una muestra estimada de 387 mujeres. Este cálculo se estableció con base en una prevalencia de 35%, con margen de error de 5% e IC95%. La selección de pacientes se hizo mediante una muestra aleatoria simple, con una tabla de números aleatorios.
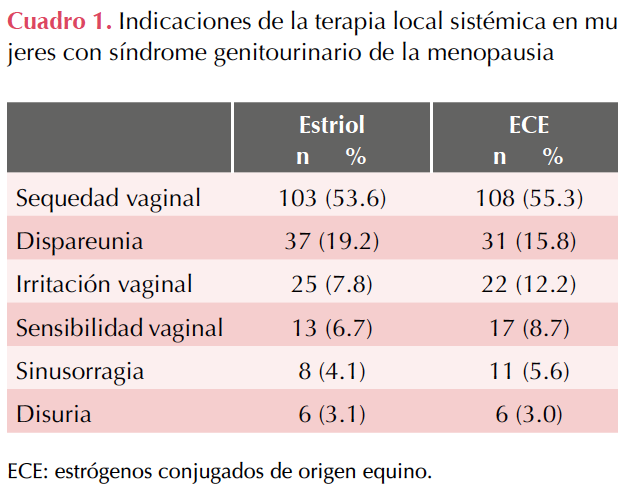
Criterios de inclusión: mujeres entre 51 y 87 años, con diagnóstico de síndrome genitourinario de la menopausia tratadas con estrógenos locales. En el Cuadro 1 se reportan las indicaciones de este tratamiento.
Criterios de exclusión: pacientes con amenorrea menor a dos años, en tratamiento hormonal, contraindicaciones absolutas para la terapia hormonal y quienes estuvieran recibiendo radioterapia o quimioterapia.
Variables de interés primario: concentraciones séricas de estradiol, testosterona total, globulina fijadora de hormonas sexuales (que se cuantificaron antes y durante el tiempo que se suministró la terapia), porcentaje de satisfacción y del tiempo libres de síntomas. También se consideraron los efectos secundarios (hemorragia uterina, irritación y prurito en el sitio de aplicación, mastalgia y náuseas). Se midieron las siguientes variables: pH vaginal (menor de 4.5), puntuación del índice de maduración vaginal, intensidad de la sequedad vaginal, necesidad de terapia hormonal sistémica, medición del endometrio y el comportamiento sexual (medido en frecuencia coital de la semana anterior al control).
El índice de maduración vaginal se utiliza para evaluar el grado de estrogenización del epitelio vaginal; expresa la proporción obtenida mediante un recuento al azar de tres tipos de células vaginales (parabasales, intermedias y superficiales), que se desprenden del epitelio escamoso.14,15 Tiene un rango de 0 a 100, con un valor de maduración expresado así: 0 a 49, 50 a 64 y 65 a 100, que indican bajo, moderado y alto efecto de estrógeno, respectivamente. El predominio de células parabasales indica falta de estrógeno (índice de maduración vaginal
≤ 49). El mayor porcentaje de células superficiales significa estimulación estrogénica (índice de maduración vaginal mayor de 65). Un índice de maduración vaginal: 50-64 expresa un efecto estrogénico moderado.16 En la mujer posmenopáusica se incrementan las células parabasales, mientras las superficiales disminuyen.17,18
La intensidad de la sequedad vaginal se mide de forma objetiva con una tira de papel tornasol que al ponerse en contacto con la vagina indica, en milímetros, el grado de humedad vaginal.19 El papel tornasol se deja puesto, en contacto con el introito, durante un minuto, luego se mide la longitud del humedecimiento. El pH vaginal se cuantifica con una tira de prueba de pH vaginal.
Para la evaluación del porcentaje de satisfacción por disminución de los síntomas se diseñó una tabla de evaluación subjetiva que reporta: satisfacción (disminución de más del 75%), buena (disminución de 50-74%), regular (disminución de 25-49%) y mala (disminución menor a 25% de los síntomas).
Para asistir al control se solicitó a las pacientes abstenerse de tener actividad sexual 72 horas previas al estudio.
La asignación aleatoria se efectuó en bloques de tres, estratificados según el centro, con el programa estadístico RALLOC, versión 3.5.2. El cegamiento se hizo con sobres opacos que contenían el grupo de estudio al que pertenecía la paciente a tratar.
Luego de la incorporación al estudio de cada paciente una enfermera profesional (ajena al equipo de investigación) abría de forma consecutiva un sobre opaco con el grupo de estudio y entregaba el tubo con la crema que debía aplicarse. Los fármacos se prepararon en tubos iguales, donde cada gramo de la crema de estriol contenía 1 mg, y el de estrógenos conjugados de origen equino 0.625 mg por cada gramo, ambos sin características que permitieran evidenciar el medicamento usado. La crema con el número de asignación al azar de cada mujer le fue entregada al ginecólogo encargado del seguimiento, quien desconocía el medicamento entregado a la paciente.
El tratamiento local con estrógeno se suministró de la misma forma a todas las mujeres: al grupo A se le indicó, al inicio, aplicar medio gramo diario de estriol durante 14 días, y luego una vez a la semana; al grupo B se le indicó, al inicio, aplicar 1 gramo diario de estrógenos conjugados de origen equino durante 14 días, y luego una vez a la semana; intravaginal, en la noche, antes de irse a dormir.
Las concentraciones séricas de estradiol, testosterona total y globulina fijadora de hormonas sexuales se cuantificaron al ingreso del estudio y luego cada seis meses (6, 12, 18 y 24 meses), hasta la finalización del estudio. Para evaluar el grosor endometrial después de la determinación del pH vaginal, puntuación del índice de maduración vaginal, medición de la intensidad de la sequedad vaginal se efectuó una ecografía pélvica transvaginal.
En las pacientes que no reaccionaron favorablemente al tratamiento tópico vaginal se rompió el método ciego para que el ginecólogo continuara el tratamiento sistémico que considerara pertinente según las condiciones individuales de cada mujer.
Las participantes desconocieron, en todo momento, las variables y la intervención a evaluar, que registró el ginecólogo en un formulario diseñado por el grupo investigador.
La información obtenida se almacenó, tabulada y analizada, en una base de datos electrónica de Excel (con distribución del total de la población de pacientes seleccionadas). El análisis estadístico se efectuó con el programa SPSS Windows versión 15.0.
Las variables cuantitativas se presentan como variables continuas mediante medidas de tendencia central y dispersión. Las variables categóricas (frecuencias y proporciones) y continuas se expresan con media y desviación estándar. La comparación inicial entre los dos grupos de estudio se realizó con la prueba t de Student para variables continuas y χ² para variables categóricas. Nivel de significación p ≤ 0.05.
El estudio fue aprobado por el comité de Ética y Bioética de la Clínica La Sagrada Familia; se cumplieron los requisitos para la investigación en humanos según la Declaración de Helsinki y la Resolución 8430 de 1993 del Ministerio de Salud de Colombia.
RESULTADOS
Se seleccionaron 849 pacientes y excluyeron 462 (171 por dificultades con la preparación de la medicación a suministrar; 198 no aceptaron participar en el estudio y 93 no cumplieron los criterios de inclusión). Al final se incluyeron 387 mujeres de las que 192 recibieron estriol (Grupo A) y 195 estrógenos conjugados de origen equino (Grupo B).
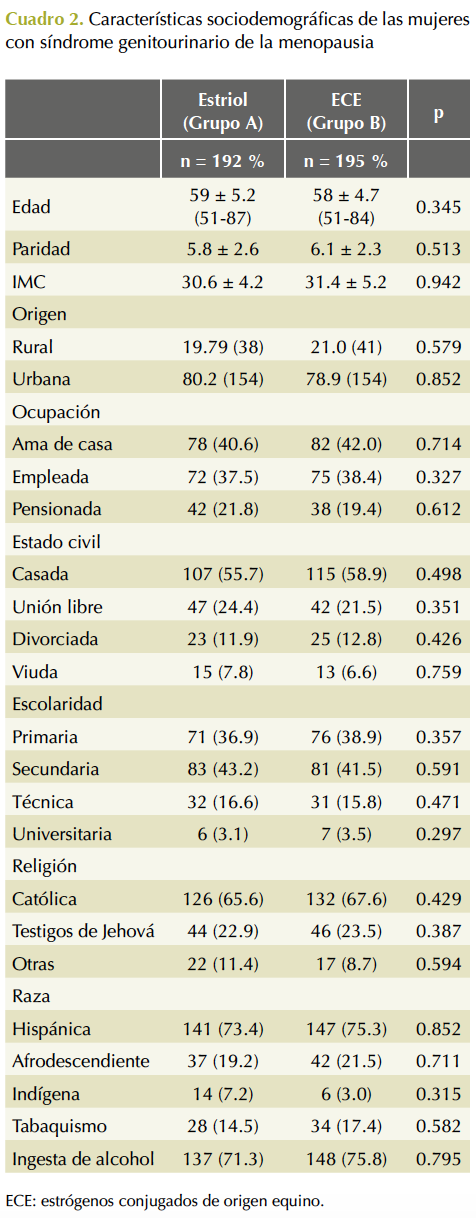
No hubo una diferencia estadísticamente significativa en la edad, ni de importancia clínica; todas las participantes cursaban el periodo posmenopáusico. El resto de las características sociodemográficas del estudio fueron similares (Cuadro 1). El 73.6% eran de estrato socio-económico bajo o medio. El 89.9% estaban en unión estable y 68.9% convivían con la pareja. El 48.8% refirió educación universitaria. La indicación más frecuente del tratamiento local con estrógeno fue la sequedad vaginal que coexistió en 53.6 y 55.3% de las mujeres en cada grupo. Cuadro 2
Al final del estudio no se encontró diferencia estadísticamente significativa en el porcentaje de satisfacción de disminución de los síntomas (grupo A: 90.6% vs grupo B: 89.2%) (p = 0.507).
En la comparación de las concentraciones séricas de estradiol al ingreso del estudio, en los dos grupos, no se encontraron diferencias. La concentración media de estradiol sérico fue de 41.4 ± 11.4 pg/mL para el grupo A y de 43.2 ± 13.5 pg/mL para el grupo B (p = 0.384). Tampoco se encontró diferencia estadísticamente significativa al final del estudio, 52.8 ± 13.5 pg/mL para el grupo A y 54.6 ± 11.7 pg/mL para el grupo B (p = 0.429).
Los valores séricos de testosterona total al inicio fueron: grupo A: 27 ± 11.4 ng/dL vs grupo B: 24 ± 13.2 ng/dL; globulina fijadora de hormonas sexuales, grupo A: 79.2 ± 14.7 nmol/L vs grupo B: 73.8 ± 16.2 nmol/L; no hubo diferencias estadísticamente significativas (p = 0.342). Al final del estudio tampoco se encontró diferencia estadísticamente significativa en las concentraciones séricas de testosterona total (grupo A: 28.2 ± 10.8 ng/dL vs grupo B: 27.3 ± 11.4 ng/dL), ni en las concentraciones séricas de globulina fijadora de hormonas sexuales (grupo A: 81.6 ± 10.2 nmol/L vs grupo B: 80.7 ± 13.8 nmol/L) (p = 0.351). Tampoco se observaron diferencias en la mayor parte de los resultados secundarios.
Se encontraron diferencias significativas, entre los dos grupos, en el tiempo de desaparición de los síntomas, que fue menor en el grupo de estriol (4.8 ± 1.05 semanas vs 6.33 ± 1.02 ± 1.02 semanas; p = 0.012) y en los efectos secundarios, que también fueron menores en el grupo de estriol (7.5 ± 2.4% vs 9.6 ± 2.7%; p = 0.024). En el grupo A (estriol) se requirió romper el ciego en 18 mujeres y en 21 mujeres del grupo de B (estrógenos conjugados de origen equino), pero en ninguna se modificó el tratamiento tópico.
En el grupo A el puntaje del índice de maduración vaginal al ingreso fue de 38.1 ± 4.5, pero aumentó a 59.4 ± 2.7 a los seis meses y alcanzó 79.5 ± 8.7 al final del estudio. En el grupo B el puntaje del índice de maduración vaginal al ingreso fue de 37.5 ± 3.6, se incrementó a 61.5 ± 3.0 a los seis meses y alcanzó 82.8 ± 9.6 al final del estudio. Estos cambios en el puntaje del índice de maduración vaginal se acompañaron de disminuciones en el pH vaginal, que inicialmente fue de 5.7 ± 1.3 (grupo A) y 5.8 ± 1.0 (grupo B), pero disminuyó a 5.1 ± 1.0 y 5.2 ± 1.0 a los seis meses de terapia, respectivamente; alcanzó 4.2 ± 0.5 (grupo A) y 4.4 ± 0.5 (grupo B) al final del estudio. No se encontró diferencia estadísticamente significativa en ninguna de las variables.
El comportamiento sexual, entre los dos grupos, durante los meses de seguimiento no reportó diferencias significativas, aunque en las mujeres con estriol la frecuencia coital fue mayor (2.0 veces vs 1.8 veces en la última semana). Esta diferencia no resultó estadísticamente significativa.
En el grupo A fue menor el porcentaje de pacientes con mastalgia, 25.5% (n = 49) versus 45.6% (n = 89) del grupo B. A pesar de que la frecuencia fue alta, el porcentaje de pacientes con mastalgia moderada a severa fue muy bajo; por lo tanto, no hay diferencia estadísticamente significativa.
El porcentaje de hemorragia uterina fue superior en el grupo B, 49.2% (n = 96) versus 26.5% (n = 51) del grupo A, encontrándose que el uso de estrógenos conjugados de origen equino se asoció de manera significativa con este efecto adverso (p = 0.021). Además, se encontró una tendencia no significativa a más efectos adversos cuando se requirió la combinación de terapia sistémica.
La irritación y prurito en el sitio de aplicación fueron menores en el grupo de estriol 15.6%
(n = 30) versus 41.5% (n = 81) en el de estrógenos conjugados de origen equino, diferencia estadísticamente significativa (p = 0.027). Los demás desenlaces estudiados no mostraron diferencia estadísticamente significativa.
Los otros resultados secundarios, como: medición de la sequedad vaginal, incidencia de náuseas y necesidad de terapia hormonal sistémica, fueron bajos y no mostraron diferencias entre los dos grupos.
La línea endometrial para el grupo A al final del estudio fue de 4.17 ± 0.51 mm versus 4.3 ± 0.54 mm para el grupo B, diferencia que resultó no estadísticamente significativa (p = 0.714).
El total de mujeres con efectos secundarios fue de 148 (38.2%); de las que 26.5% (n = 51) pertenecían al grupo A y 49.2% (n = 96) al grupo B. En las mujeres del grupo A, 10.9% (21) experimentaron, al menos, dos efectos secundarios, y en las del grupo B, 38.4% (n = 75) sufrieron dos o más efectos secundarios.
DISCUSIÓN
En esta investigación se demuestra que el estriol y los estrógenos conjugados de origen equino son opciones de tratamiento local igual de efectivas y seguras para aliviar los síntomas genitourinarios de la menopausia. La respuesta favorable varía entre 89.2 y 90.6%, porcentajes similares a los reportados por otras publicaciones.10
En este estudio no se encontró diferencia en los resultados de las concentraciones séricas de estradiol cuando se usan estriol o estrógenos conjugados de origen equino por más de seis meses (que permanecieron en el rango de mujeres posmenopáusicas). Se observaron porcentajes satisfactorios de disminución de los síntomas vaginales de las pacientes tratadas, hallazgos concordantes con otros estudios.20,21,22
Las concentraciones séricas de testosterona total y de globulina fijadora de hormonas sexuales no mostraron cambios significativos a lo largo de la terapia, lo que demuestra que la aplicación local de estriol o estrógenos conjugados de origen equino no influye en las concentraciones séricas de estas hormonas.
Los efectos positivos de la terapia local con estrógenos fueron bastante evidentes en ambos grupos después de dos semanas de tratamiento. Con el propósito de alcanzar la mayor disminución de los síntomas del síndrome genitourinario en la menopausia, de acuerdo con este estudio, se recomienda una terapia local con estrógenos de al menos cuatro semanas, aplicada según las indicaciones.
En este estudio los dos fármacos resultaron bien tolerados y efectivos para aliviar los síntomas de la atrofia vaginal, tal como había sido descrito por otros autores;23 se dan mejoras fisiológicas que representan una reversión de la atrofia vaginal y conducen a un resultado clínico satisfactorio en la mayoría de las mujeres.
En Colombia, las opciones de terapia estrogénica local más prescritas son el estriol y los estrógenos conjugados de origen equino, que una vez más han demostrado sus efectos importantes en el tejido vulvo-vaginal (incremento del flujo sanguíneo, de las secreciones vaginales, del grosor del epitelio vaginal, disminución del pH vaginal, restauración de la flora vaginal y prevención de infecciones vaginales o urinarias).24,25 En la búsqueda bibliográfica efectuada no se encontró algún estudio que comparara las variables descritas en este estudio, entre estas dos terapias locales.
Los resultados de nuestra investigación no mostraron diferencia significativa entre los valores del pH vaginal, puntuación del índice de maduración vaginal y medición de la intensidad de la sequedad vaginal; por lo tanto, se demuestra la efectividad de ambas moléculas como terapia estrogénica local, tal como ha sido descrito por otras investigaciones.2,26,27
En este estudio no hubo diferencias estadísticamente significativas en la necesidad de requerir terapia hormonal sistémica, lo que una vez más ubica al tratamiento local con estrógeno como efectivo, seguro y bien tolerado, tal como ha sido destacado por otros estudios.2,26,27
Se reconoce que este estudio mostró un significativo porcentaje de efectos secundarios; aun así, fueron menores a los reportados en la bibliografía,25 y mucho menores en las mujeres que utilizaron estriol.
En esta investigación el grupo de estriol tuvo mayor frecuencia coital, aunque no clínicamente significativa, quizá por menor aparición de efectos secundarios.
A pesar del tiempo prolongado de la terapia hormonal, las concentraciones séricas de estradiol permanecieron dentro del nivel posmenopáusico normal y no hubo un solo caso de hiperplasia o adenocarcinoma endometrial, lo que es concordante con la bibliografía revisada.28
En las pacientes del estudio pudo demostrarse el inmediato alivio de los síntomas, así como la reversión de los cambios anatómicos atróficos.2,29-31 No fue necesario agregar un progestágeno para la protección endometrial, a pesar de que la terapia se suministró por más de un año, debido a las bajas dosis utilizadas y a su aplicación semanal.
Los resultados del estudio destacan la magnífica utilidad de la terapia local con estrógeno en la mujer con síndrome genitourinario de la menopausia, puesto que disminuye significativamente los síntomas y no altera las concentraciones séricas de estradiol, testosterona total y globulina fijadora de hormonas sexuales, lo que la hace segura de usar en todo tipo de población que la amerite.
A pesar de que la línea endometrial en este grupo de mujeres fue mayor de 4 mm, no se llevó a cabo ninguna intervención diferente al ultrasonido para el seguimiento porque algunos autores no la recomiendan si la línea endometrial es menor de 5 mm.32
Se reconoce que este trabajo tiene múltiples limitaciones, entre ellas que no se evaluaron otras 462 mujeres que pudieron haber sido incluidas en la asignación al azar, además de que solo se efectuó en tres instituciones donde se utilizó el mismo protocolo para la terapia local con estrógeno, por lo que los resultados no pueden generalizarse a otras mujeres que usen dosis diferentes. Tampoco se evaluó, objetivamente, el efecto de la intervención en la percepción de las mujeres respecto del tratamiento local con estrógenos, aunque fue muy bien acogida la terapia en la población del estudio. Es necesario que en futuros estudios se evalúen estos aspectos tan relevantes a la hora de la elección de una terapia de estas características. El estriol es una terapia usada con frecuencia en nuestra región (Eje Cafetero), no obstante, es probable que el costo no le permita ser utilizada por otras mujeres con bajos ingresos.
Se considera como una fortaleza de este estudio que el incremento en la actividad sexual, reportada por las mujeres, se puede considerar clínicamente significativo, teniendo en consideración la naturaleza negativa que el síndrome genitourinario en la menopausia ofrece para este grupo poblacional. En futuros estudios sería interesante poder evaluar las implicaciones sexuales que el tratamiento local con estrógeno pueda conllevar en relación con el aumento en la frecuencia coital, de manera más detallada.
CONCLUSIÓN
El estriol y los estrógenos conjugados de origen equino son igualmente efectivos y seguros en el tratamiento del síndrome genitourinario de la menopausia; sin embargo, el estriol demostró mayores ventajas que los estrógenos conjugados de origen equino al ofrecer menor tiempo para disminuir los síntomas y menores efectos secundarios.
Agradecimientos
A las pacientes que participaron en este estudio y a la Clínica La Sagrada Familia por permitirnos llevar a cabo esta investigación, así como al equipo de trabajo participante y al Dr. David Vásquez Awad por facilitarnos sus experiencias y conocimientos.
Financiamiento
No hubo fuentes de financiamiento que declarar porque el estudio se llevó a cabo con recursos propios del autor principal.
REFERENCIAS
- Portman DJ, Gass ML. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and the North American Menopause Society. Menopause. 2014;21(10):1-6.
- Espitia de La Hoz, FJ; Orozco Gallego, H. Abordaje diagnóstico y terapéutico del síndrome genitourinario en la menopausia; actualización. 2017. 11(2)7:67-84.
- Palacios S. Managing urogenital atrophy. Maturitas 2009; 63:315-8.
- DiBonaventura M, Luo X, Moffatt M, Bushmakin AG, Kumar M, Bobula J. The association between vulvovaginal atrophy symptoms and quality of life among postmenopausal women in the United States and Western Europe. J Womens Health (Larchmt) 2015; 24:713-22.
- Calleja-Agius J, Brincat MP. Urogenital atrophy. Climacteric.2009; 12(4):279–285.
- Panay N. Genitourinary syndrome of the menopause –dawn of a new era. Climacteric. 2015;18(1):13–17.
- Mehta A, Bachmann G. Vulvovaginal complaints. Clin Obstet Gynecol. 2008;51(3):549–555.
- Portman DJ, Gass ML. Vulvovaginal Atrophy Terminology Consensus Conference Panel. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and the North American Menopause Society. Menopause 2014; 21:1063-8.
- Nappi RE, Palacios S. Impact of vulvovaginal atrophy on sexual health and quality of life at postmenopause. Climacteric 2014; 17:3-9.
- The North American Menopause Society (NAMS). Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society. Menopause 2013; 20:888-902.
- Bachmann G, Bouchard C, Hoppe D, et al. Efficacy and safety of low-dose regimens of conjugated estrogens cream administered vaginally. Menopause. 2009;16(4):719–727.
- Simon J, Nachtigall L, Ulrich LG, Eugster-Hausmann M, Gut R. Endometrial safety of ultra-low-dose estradiol vaginal tablets. Obstet Gynecol 2010; 116:876–83.
- Bennink HJ. Reprint of Are all estrogens the same? Maturitas 2008; 61:195-201.
- McEndree B. Clinical application of the vaginal maturation index. Nurse Pract. 1999 Sep;24(9):48, 51-2, 55-6.
- Van der Laak JA, Schijf CP, Kerstens HM, Heijnen-Wijnen TH, de Wilde PC, Hanselaar GJ. Development and validation of a computerized cytomorphometric method to assess the maturation of vaginal epithelial cells. Cytometry. 1999 Mar 1;35(3):196-202.
- Meisels, A. The Maturation value. Acta Cytol, 1967.11(4):249.
- Brizzolara S, Killeen J, Severino R. Vaginal pH and parabasal cells in postmenopausal women. Obstet Gynecol 1999;94 (5 Pt 1):700-703.
- Willhite, L. & O’Connell, M. B. Urogenital atrophy: prevention and treatment. Pharmacotherapy, 2001; 21, 464-480.
- Carranza-Lira S, Fragoso-Díaz N, MacGregor-Gooch AL, Garduño-Hernández MP, Ríos-Calderón K, et al. Vaginal dryness assessment in postmenopausal women using pH test strip. Maturitas 2003;45(1):55-58.
- Santen RJ, Pinkerton JV, Conaway M, et al. Treatment of urogenital atrophy with low-dose estradiol: preliminary results. Menopause 2002; 9:179-87.
- Bachmann G, Lobo RA, Gut R, Nachtigall L, Notelovtz M. Efficacy of low-dose estradiol vaginal tablets in the treatment of atrophic vaginitis. A randomised controlled trial. Obstet Gynecol 2008; 111:67-76.
- Eugster-Mausmann M, Waitzinger J, Lehnick D. Minimized estradiol absorption with ultra-low dose 10 mcg 17 b-estradiol vaginal tablets. Climacteric 2010; 13: 219-27.
- Dorr MB, Nelson AL, Mayer PR, et al. Plasma estrogen concentrations after oral and vaginal estrogen administration in women with atrophic vaginitis. Fertil Steril. 2010;94(6):2365-2368.
- Simon J, Nachtigall L, Gut R, Lang E, Archer DF, Utian W. Effective treatment of vaginal atrophy with an ultra-low-dose estradiol vaginal tablet. Obstet Gynecol. 2008;112(5):1053-1060.
- Suckling J, Lethaby A, Kennedy R. Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev. 2006;4:CD001500.
- Sturdee DW, Panay N. Recommendations for the management of postmenopausal vaginal atrophy. Climacteric. 2010;13(6):509-522.
- Espitia-De La Hoz, FJ, Orozco, Gallego, H, Echeverri, Ocampo, LM. Terapia hormonal y no hormonal en la vaginitis atrófica posmenopáusica: cura y satisfacción a mediano y a largo plazo de los síntomas. Rev. Col. de menopausia. 2016; 22(1):8-17.
- Rahn DD, Carberry C, Sanses TV, Mamik MM, Ward RM, Meriwether KV, et al. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014; 124:1147-1156.
- Panay N, Hamoda H, Arya R, Savvas M. The 2013 British Menopause Society & Women’s Health Concern recommendations on hormone replacement therapy. Menopause Int 2013; 19(2):59-68.
- Hansen KA, Eyster KM. What Happened to WHI: Menopausal Hormonal Therapy in 2012. Clin Obstet Gynecol 2012; 55(3): 706-12.
- Griesser H, Skonietzki S, Fischer T, Fielder K, Suesskind M. Low dose estriol pessaries for the treatment of vaginal atrophy: A double-blind placebo-controlled trial investigating the efficacy of pessaries containing 0.2 mg and 0.03 mg estriol. Maturitas 2012; 71: 360-8.
- Granberg S, Wikland M, Karlsson B, Norström A, Friberg LG. Endometrial thickness as measured by endovaginal ultrasonography for identifying endometrial abnormality. Am J Obstet Gynecol 1991; 164:47-52.




